选择胶原蛋白产品时,“械字号”级别直接关联其安心等级与效能水准。市面上“械二”与“械三”产品并存,二者在监管强度、审批周期、生产工艺及适用场景上存在明确差异。了解这些差异,有助于做出适宜判断。

一、医疗器械分类体系与胶原蛋白的地位
监管框架与层级意义
在我国医疗器械分类目录中,依据风险程度实行三阶管理。类别越高,表明监管越严格,其审评标准、生产环境及质量控制要求也更为苛刻。
对于胶原蛋白类产品,若源于动物提取,通常按第三类医疗器械管理。重组胶原蛋白的管理类别则不低于第二类。这意味着重组胶原蛋白产品的起点是械二,但其技术含量和可靠性若达到更高标准,则可申报并获批为械三。
三类医疗器械的审批流程因其高风险属性而极为漫长,拿证周期通常在2至3年左右,远长于二类械的约1年周期。这种时间投入和合规成本构成了行业的进入壁垒。
二、械二与械三胶原蛋白的核心差异
审批要求与上市流程
审批流程的繁简程度是二者首要区别。第二类医疗器械实行注册管理,需要提供相对详细的资料包括临床评价资料,并经过医疗器械质量管理体系考核现场检查,通过后才能发证。
第三类医疗器械的审批则更为严格,其审批流程严格、研发投入大。获批企业可通过特有产品形成行业技术壁垒。例如,锦波生物自主研发的“重组Ⅲ型人源化胶原蛋白冻干纤维”于2021年6月获准上市,是当时仅有的注射级别重组III型人源化胶原蛋白生物医用材料。
原料与成分要求
械字号产品对原料、配方和生产过程的监管极为严格。在原料上,要求使用医药级原料和注射用水。配方讲究成分精简,以核心活性原料为主,防腐剂、成膜剂等添加较少,以此降低致敏可能性。
械三产品在此方面的要求达到顶峰。例如锦波生物获批的“注射用重组Ⅲ型人源化胶原蛋白凝胶”,其成分单一,不含交联剂或其他化学成分,仅由A型重组Ⅲ型人源化胶原蛋白和0.9%的生理盐水组成。这种极高的纯度要求消除了免疫原性,确保了良好的生物可靠性。

生产环境与质量控制
生产环境是确保产品可靠性的关键环节。所有械字号产品生产都需符合GMP要求车间。其中,二类、三类械更要求无菌环境。
三类械的生产环境标准是无菌要求的更高阶,以确保产品在注射过程中的放心可靠,更大程度避免污染风险。随着监管趋严,此前部分按一类械管理的产品(如某些冷敷贴)已不得继续生产和进口,市场正朝着更加规范的方向发展。
预期用途与功效定位
产品的分类也与其预期用途和功效紧密相关。第二类医疗器械胶原蛋白产品,其预期用途可能侧重于浅表层的改善,例如某些用于小创口、擦伤、切割伤等浅表性创面及周围皮肤护理的液体成膜敷料。
而第三类医疗器械胶原蛋白产品则主要用于皮下植入或注射,涉及更深层次的组织修正。如锦波生物的“注射用重组Ⅲ型人源化胶原蛋白凝胶”,适用于矫正中面部容量缺失和/或中面部轮廓缺陷,注射层次为中面部皮下至骨膜上层,注射后可对细胞、组织起支撑作用。其“重组Ⅲ型人源化胶原蛋白冻干纤维”则用于面部皱纹纠正。这类产品作用层次更深,用途更为明确,因此监管等级更高。
三、从胶原蛋白类型看产品选择
I型与III型的角色分工
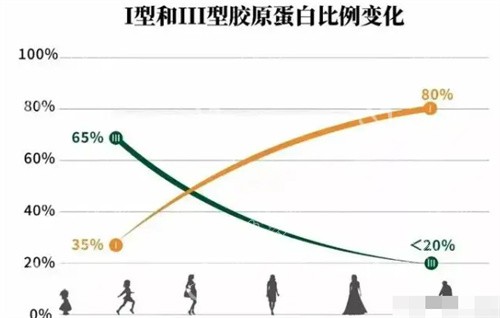
胶原蛋白的类型也影响其功能和适用性。人体内胶原蛋白种类繁多,在皮肤中主要为I型和III型。
I型胶原蛋白大多存在于成人皮肤组织、肌腱组织中,像钢筋一样,主要起塑形支撑作用,让皮肤结实、撑起来。
III型胶原蛋白则通常更多地存在于婴儿皮肤中,它像细细的网兜,可以增加皮肤柔软度和弹性。其与人体贴合度比较高,排异性更低一些。
一些出色的产品会同时考虑I型和III型的协同作用。例如丸美的重组胶原蛋白次抛小金针精华就同时添加了与人体全部同源的I型 + III型重组胶原蛋白,I型胶原将下垂脸提拉起来,III型充盈胶原让干瘪的脸蛋饱满起来。

人源化重组技术的优势
传统的动物源胶原蛋白存在免疫原性风险,其分子结构大,皮肤无法有效吸收,且与人体胶原相比亲和力更弱。
重组人源化胶原蛋白技术通过生物合成方法,生产出与人体胶原序列全部一致的产品。这样的“自己人”不易引起排异或过敏反应,很自然就被肌肤吸收了。
锦波生物的重组人源化胶原蛋白产品即采用了合成生物法生产,其技术优势显著。例如其“注射用重组Ⅲ型人源化胶原蛋白凝胶”是海内外头一个通过自组装、自交联技术,利用合成生物法生产的相关产品。
四、市场现状与产品辨识
头部企业的布局与竞争
目前,锦波生物包揽了国内仅有的三张重组人源化胶原蛋白第三类医疗器械注册证(“械三证”)。这些产品覆盖了面部抗衰、填充等多种医美需求。
其旗下品牌薇旖美(重组人源化胶原蛋白冻干纤维)是公司医疗器械业务板块的重点产品,2024年营收为12.54亿元,同比增长84.37%,毛利率达到95.03%,占其总营业收入的86.9%。截至2024年年末,薇旖美已覆盖终端医疗机构约4000家,数量较2023年翻了一倍。
市场上已有多家头部医美企业正在申请重组胶原蛋白领域的“械三证”,例如巨子生物、创健医疗、华熙生物、敷尔佳、福瑞达等均处于“械三类”产品申请的不同阶段。这表明未来该领域的竞争可能会加剧,但同时也推动了行业整体技术水平的提升。
普通消费者如何辨识
对于普通消费者而言,辨识械二与械三产品更直接的方法是查看产品包装或官网宣传信息中标注的医疗器械注册证编号。
第三类医疗器械注册证的编号为国械注准XXXXXXXXXXX,而第二类医疗器械注册证的编号通常为省/直辖市简称+械注准XXXXXXXXXXX。消费者可在相关药品监管管理部门网站查询该编号以验证其真实性。
此外,产品的预期用途和注射层次也是判断其级别的参考。凡涉及皮下注射、填充、支撑等用途的胶原蛋白产品,通常应按第三类医疗器械管理。例如“水光注射”类产品(注射用透明质酸钠溶液)已明确要求按照三类器械监管。
胶原蛋白械二与械三的区别,本质上是安心与效能层级的不同。械三代表更严格的监管、更高的生产标准及更明确的临床功效,尤其适用于深层注射与组织修正。了解这些差异,是做出明智选择的基础。



